Het expertiseteam voor cystenieren in het UMCG ziet jaarlijks honderden patiënten met autosomaal polycysteuze nierziekte (ADPKD). Hoewel er sinds kort effectieve medicatie beschikbaar is voor deze aandoening, zijn er ook verschillende niet-medicamenteuze behandelopties, en juist op dat gebied zijn er veel nieuwe ontwikkelingen.
Het expertiseteam bestaat uit postdocs, onderzoeksverpleegkundigen, promovendi en 2 nefrologen. Eén van hen is Esther Meijer. Zij werkt sinds 2017 als internist-nefroloog in het UMCG, waar zij in 2011 ook promoveerde op onderzoek naar ADPKD, ook wel cystenieren (zie kader). Ze houdt zich dus al lang bezig met deze aandoening. “Elke week zie ik veel patiënten met cystenieren. Omdat wij een expertisecentrum zijn op dit gebied, zien we naast onze ‘eigen’ patiënten ook mensen die komen voor een second opinion, het instellen van een specifieke behandeling of deelname aan onderzoek”, aldus Meijer.
Tolvaptan
Pas sinds enkele jaren is er effectieve medicatie beschikbaar in de bestrijding van ADPKD. Tolvaptan blokkeert selectief de vasopressine V2-receptoren in de nieren en verhindert daardoor de binding van het lichaamseigen hormoon vasopressine, ook bekend als het antidiuretisch hormoon (ADH). Het middel remt de cystegroei in de nieren en vertraagt achteruitgang van de nierfunctie bij volwassenen met chronische nierschade stadium 1-4 bij wie de ziekte tekenen van snelle progressie toont. Hoewel Tolvaptan zeer effectief is, heeft het ook een aantal vervelende bijwerkingen, waarbij dorst (55%), polyurie (38%) en nycturie (29%) op de voorgrond staan.1
Leefstijl
“Binnen de geneeskunde ligt er veel nadruk op behandeling met medicatie, maar juist bij ADPKD zijn er verschillende behandelopties op het gebied van leefstijl waar je mogelijk veel mee kunt bereiken. Het is mooi om te zien dat er momenteel zoveel nieuw onderzoek wordt gedaan naar deze interventies”, vindt Meijer.2 Een grote rol is weggelegd voor voedingsadviezen. Meijer legt uit dat veel van deze adviezen gelden voor alle patiënten met een chronische nierziekte. “Voor lang niet alle voedingsadviezen is specifiek uitgezocht hoe het zit met cystenieren, maar voor sommige wel.”
Zout- en eiwitinname
“Ten eerste is het belangrijk om de zoutinname te beperken om hypertensie te voorkomen, helemaal bij ADPKD-patiënten omdat zij een verhoogd risico hebben op hypertensie, ook al op jonge leeftijd. Daarnaast zijn er aanwijzingen dat zout intrinsiek de ziekte kan verergeren. Verschillende observationele onderzoeken toonden aan dat de mensen die het meeste zout eten het grootste niervolume hebben en de meeste achteruitgang in nierfunctie. Ook een posthoc-analyse van de Amerikaanse HALT-studie naar bloeddrukbehandeling liet zien dat mensen met cystenieren die zich houden aan aanbevelingen voor zout het beter doen, met minder nierfunctiedaling en groei van de nieren.”
Een andere factor die specifiek onderzocht is bij ADPKD is eiwitinname, maar er is tot nu toe geen bewijs gevonden voor gunstige effecten van eiwitbeperking.
Tipje van de sluier
In 2019 ontving Meijer een Kolff-beurs van de Nierstichting voor studies naar het beperken van de bijwerkingen van tolvaptan. Een daarvan is een kleine RCT waarin patiënten met een hoge en lage zoutinname en een hoge en lage eiwitinname vergeleken werden. De RCT is net afgerond, maar het artikel is nog niet gepubliceerd. Toch wil Meijer wel vast een tipje van de sluier oplichten over de resultaten: “We vonden dat reductie van zowel de zout- als eiwitinname zorgde voor een lager urinevolume, maar die afname was wel minder groot dan we verwachtten. Vooral een lagere zoutinname bleek wel het copeptin (voorloper van vasopressine) te verlagen. Dat betekent dat beperkte zoutinname op termijn wellicht renoprotectief werkt en er dus ook bij ADPKD-patiënten die behandeld worden met tolvaptan een rol is voor zoutbeperking.”
Cafeïne
Verder is er speciale aandacht voor de invloed van cafeïne op cystenieren. In een celmodel bleek namelijk dat cysteniercellen harder gingen groeien en meer cysten ontwikkelden wanneer cafeïne werd toegevoegd. Dat komt mogelijk doordat cafeïne het cyclisch AMP verhoogt. In observationele onderzoeken kon echter niet worden bevestigd dat koffie-inname de ziekte erger maakt. “Ik leg patiënten daarom altijd uit dat koffie op theoretische gronden niet goed voor ze is, maar dat we dat in de praktijk niet terugzien. Ik adviseer hen daarom om matig te zijn met koffie, maar om niet te streng te zijn voor zichzelf als het om koffie gaat”, aldus Meijer.
Waterinname
Ook de waterinname heeft mogelijk effect op cystenieren. Meijer: “De gedachte is dat veel water drinken een alternatief kan zijn voor behandeling met tolvaptan, want ook daarmee onderdruk je het ADH en verminder je de activiteit van de vasopressine-V2-receptor. Nefrologen zijn gewend om cystenierpatiënten te adviseren om veel water te drinken, omdat dat op theoretische gronden goed voor ze is. Hoewel dat waarschijnlijk klopt, is het maar de vraag of drinken wel zo efficiënt is om je vasopressine te onderdrukken. Zo kunnen patiënten ’s nachts niet drinken en vergt het veel discipline om (veel) meer te water drinken dan waar je behoefte aan hebt.”
Recentelijk is er een grote Australische RCT naar extra water drinken gepubliceerd.3 Hierin werd bij 180 cystenierpatiënten in 3 jaar follow-up geen enkel effect van de waterinname op niervolume en nierfunctie gevonden. “Hoewel op bijna elke studie wel iets af te dingen is, denk ik dat een betere studie dan dit niet gedaan gaat worden en ik betwijfel daarom of water drinken wel echt iets doet. Het effect zal in elk geval maar beperkt zijn, zeker in vergelijking met tolvaptan.”
Warburg-effect
Wat mogelijk wel een effect teweeg kan brengen, is glucosedeprivatie. “Bij cystenierpatiënten bestaat mogelijk een soort Warburg-effect, waarbij cellen veel meer glucoseafhankelijk zijn dan normaal, net zoals dat gezien wordt bij kankercellen. Dat zou betekenen dat wanneer je mensen glucose depriveert, je misschien wel selectief de cystenieren aan kunt pakken. Stel dat je ADPKD-patiënten gewicht laat verliezen, bijvoorbeeld door een energiebeperkt dieet, intermittent fasting of koolhydratenbeperking. Doet dat dan iets goeds op de cystenieren?” vraagt Meijer zich af. “Ik vind dat heel interessant en ik ben niet de enige, want er wordt veel onderzoek naar gedaan. Aanvankelijk waren dit dierstudies, maar daarna ook klinische studies en recent verschenen 2 interventiestudies. In 1 daarvan werden 28 mensen met overgewicht gerandomiseerd naar een energiebeperkt dieet of intermittent fasting. Na een jaar bleek dat het niervolume minder was gegroeid in de groep met de energiebeperking.”4
Meijer vertelt dat er nog meerdere studies op dit gebied lopen, waaronder een studie naar het effect van een ketogeen dieet (Keto-ADPKD-studie) en naar het energiebeperkte dieet op de langere termijn. “Ik ben heel benieuwd wat hier uit zal komen. Voorlopig stimuleer ik mijn patiënten om een gezond gewicht te bereiken en behouden; omdat dat belangrijk is om cardiovasculaire aandoeningen te voorkomen, maar ook omdat het mogelijk de ontwikkeling van cysten kan beperken. Voor een advies om structureel de calorie-inname te beperken of een ketogeen dieet te volgen, vind ik het nog wat te vroeg.”
ADPKD
Autosomaal polycysteuze nierziekte (ADPKD) is de meest voorkomende erfelijke nierziekte; bij 10% van alle patiënten op nierfunctievervangende therapie in Europa is ADPKD de onderliggende reden. ADPKD is ook de meest voorkomende oorzaak van cystenieren; een verzamelnaam voor chronische en progressieve erfelijke aandoeningen waarbij in de nieren cysten ontwikkelen en groeien. Deze cysten veroorzaken een progressieve vergroting van de nier en uiteindelijk daling van de nierfunctie. Hoe snel de nierfunctie verslechtert, varieert per persoon, maar de mediane leeftijd van nierfalen ligt rond 58 jaar. De cysten kunnen leiden tot pijn, bloedingen, infecties en vermoeidheid. Cystenieren hebben dan ook ingrijpende effecten op de kwaliteit van leven van de patiënten. Daarnaast hebben ADPKD-patiënten een hoger risico op hypertensie, hart- en vaatziekten en intracraniële aneurysmata.5
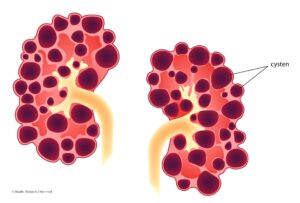
Credit: Maaike Wijnands/Nieren.nl
Referenties:
- Tolvaptan. Farmacotherapeutisch kompas.
- Meijer E, Gansevoort RT. PurposeEmerging non-pharmacological interventions in ADPKD: an update on dietary advices for clinical practice. Curr Opin Nephrol Hypertens 2021;30:482-92.
- Rangan GK, et al. Prescribed Water Intake in Autosomal Dominant Polycystic Kidney Disease. NEJM Evid 2021;1.
- Hopp K, et al. Weight loss and cystic disease progression in autosomal dominant polycystic kidney disease. iScience 2021;25:103697.
- Huisartsenbrochure cystenieren (ADPKD), 2017.